Como investigador del alzhéimer y neurólogo que atiende a personas con esta enfermedad, comparto la frustración —en realidad la ira— de las personas y las familias cuando les digo que no tengo una cura que ofrecerles.
Durante el año pasado, los científicos abordaron la covid-19, una enfermedad previamente desconocida y en unos meses desarrollaron nuevas vacunas eficaces.
Durante ese mismo período de tiempo, la lista de fracasos del tratamiento del alzhéimer se hizo más larga.
Actualmente, los únicos medicamentos aprobados para el alzhéimer simplemente alivian algunos de los síntomas, parcial y temporalmente, pero no detienen el progreso de la enfermedad.
Aunque se describió por primera vez y de manera oficial hace 115 años —aunque por supuesto existió mucho antes de eso— todavía no tenemos una cura para esta devastadora enfermedad. ¿Por qué?
Comencemos siguiendo el dinero. Durante años, los defensores de los pacientes han advertido sobre el aumento del número de víctimas y los crecientes costos del alzhéimer a medida que la población mundial envejece.
El alzhéimer tiene una financiación muy insuficiente en comparación con el cáncer, las enfermedades cardíacas, el VIH/Sida e incluso la covid-19.
Lamentablemente, la creencia errónea de que el alzhéimer solo afecta a las personas mayores es un factor que contribuye a esta falta de financiación. Sin embargo, entre el 5 y el 10% de las personas con alzhéimer tienen menos de 65 años; algunos incluso tienen 40 años.
El alzhéimer también es una enfermedad de toda la familia, que causa ansiedad, depresión y agotamiento en los cuidadores y seres queridos, lo que genera un costo socioeconómico desproporcionadamente alto.
Teorías en conflicto
La financiación no es el único problema aquí. El cerebro humano es extremadamente complejo y la enfermedad de Alzheimer es la más compleja del cerebro.
El alzhéimer puede estar presente en los pacientes unos 20 o 30 años antes de que cause síntomas.
Los desafíos que surgen de esta confluencia de complejidades se reflejan en las distintas teorías sobre el alzhéimer.
La teoría más aceptada es que el alzhéimer es causado por proteínas mal plegadas que se agregan o se agrupan, matando a las células cerebrales y dando lugar a los síntomas de pérdida de memoria y cognición reducida.
Inicialmente, el culpable de esta historia de plegamiento incorrecto era una proteína llamada beta-amiloide. Más recientemente, otra proteína, tau, ha surgido como posible contribuyente.
Aunque una gran cantidad de datos de investigación ha respaldado esta teoría del plegamiento incorrecto de proteínas, conocida como la hipótesis amiloide, múltiples fármacos diseñados para bloquear los procesos de plegamiento incorrecto de proteínas tóxicas del cerebro repetidamente han fracasado en ensayos en humanos.
De hecho, en los últimos dos años, varios ensayos clínicos importantes basados en la principal hipótesis —que la reducción del nivel de beta-amiloide agregado que acecha los cerebros de los pacientes con alzhéimer detendría la progresión de la enfermedad— han fracasado dramáticamente.
Hay varias teorías que tratan de explicar el origen del alzhéimer.
Pero hay muchas otras teorías. Una es la de la neuroinflamación, que sugiere que el alzhéimer surge de una liberación excesiva de sustancias químicas inflamatorias tóxicas de las células inmunitarias del cerebro llamadas microglías.
Los medicamentos diseñados con base en esta teoría son fundamentalmente diferentes de los que abordan la hipótesis amiloide, y aún se encuentran en las primeras etapas del proceso de desarrollo.
Una teoría diferente afirma que el alzhéimer es una enfermedad de las sinapsis, que son las uniones entre las células cerebrales, y otra sugiere que el alzhéimer es una enfermedad de las mitocondrias, una estructura central para la producción de energía en cada célula cerebral.
Desafíos para encontrar la cura
El camino hacia una cura no será fácil, e incluso si estas teorías conducen al desarrollo de fármacos, éstos pueden fallar por otras razones.
El alzhéimer es una enfermedad crónica muy prolongada, probablemente presente de 20 a 30 años antes de que los primeros síntomas se hagan evidentes.
Administrar un medicamento cuando una persona se vuelve sintomática puede ser demasiado tarde para que haga alguna diferencia.
Pero no tenemos la capacidad de diagnosticarlo 30 años antes de los primeros síntomas, e incluso si pudiéramos, tendríamos que considerar la ética de administrar un medicamento potencialmente tóxico a largo plazo a alguien que puede o no contraer una enfermedad en tres décadas.
Además, a diferencia del desarrollo de antibióticos en los que los investigadores saben en cuestión de días si el fármaco funciona, la naturaleza crónica del alzhéimer requiere ensayos largos y costosos (años de duración) antes de que se pueda obtener una respuesta.
Ese tiempo y gasto es un impedimento adicional para el desarrollo de fármacos.
Un último problema es que el alzhéimer puede no ser simplemente una enfermedad. De hecho, puede ser un conjunto de enfermedades similares.
El psiquiatra Alois Alzheimer describió el alzhéimer a inicios del siglo XX.
Una persona de 52 años con alzhéimer de aparición temprana/inicio precoz sin duda tiene una trayectoria clínica clara y diferente al de una persona de 82 años con alzhéimer de inicio tardío.
¿Un medicamento que funciona en una persona de 82 años también funcionará en una persona de 52 años? Tal vez sí, o tal vez no.
Afortunadamente, a pesar de estos muchos obstáculos, se está llevando a cabo una gran cantidad de investigaciones fascinantes y alentadoras en laboratorios de todo el mundo.
Los éxitos de la ciencia y la industria farmacéutica contra muchas otras enfermedades en el siglo pasado a menudo han surgido de la recolección de los frutos al alcance de la mano.
El alzhéimer no es una fruta madura, sino la manzana en la parte superior del árbol, y los científicos tendrán que trepar muchas ramas, muchas de las cuales nunca han sido alcanzadas, en el camino hacia la cura.
Pero llegaremos allí.
- Donald Weaver
- The Conversation*

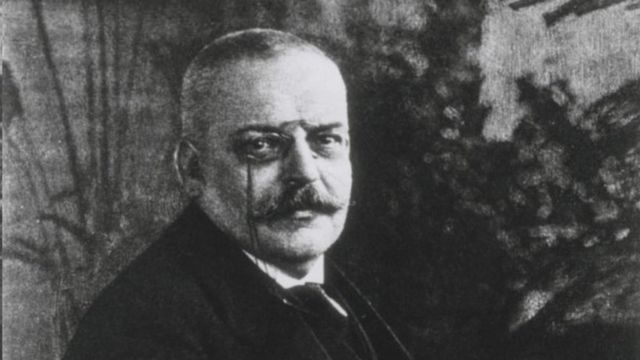



/cloudfront-eu-central-1.images.arcpublishing.com/prisa/PGTTLEVGINBORPQOT2OESKIAT4.jpg)